高島 誠司 | Seiji Takashima
信州大学繊維学部応用生物科学科 / 先鋭領域融合研究群バイオメディカル研究所 准教授
Associate professor, Department of Textile Science and Technology, Interdisciplinary Graduate School of Science and Technology, Shinshu University / Department of Biotechnology, Institute for Biomedical Sciences, Interdisciplinary Cluster for Cutting Edge Research, Shinshu University
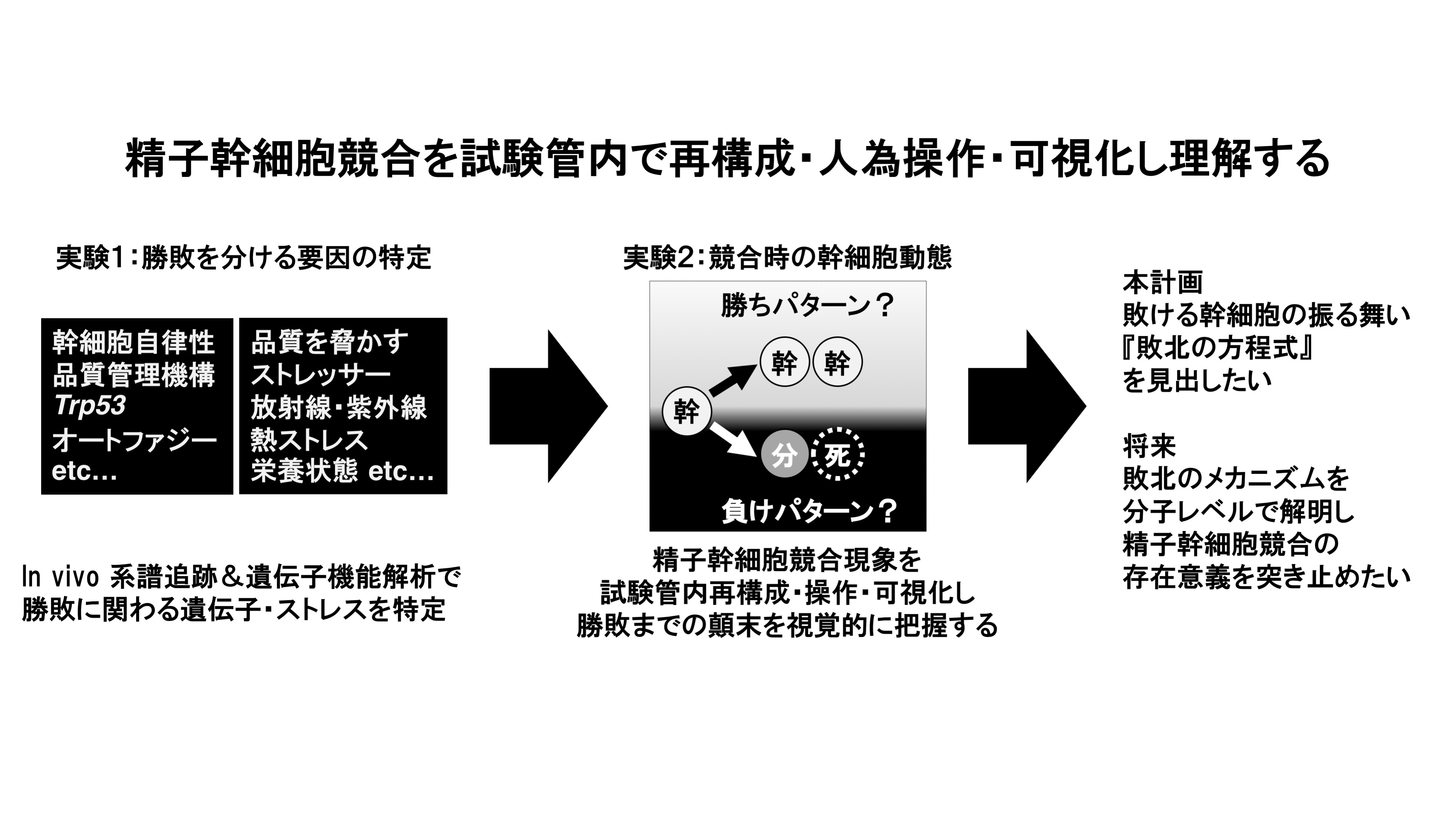
幹細胞競合は、幹細胞の選良機構としての機能を介し、組織の恒常性維持に貢献する。そこでは、幹細胞同士がfitnessを指標に覇権を争い、勝者クローンは自己複製によりその勢力を拡大し、敗者クローンは分化・細胞死などにより舞台を去る。この仕組みを解明するには、幹細胞競合の勝敗を決定する責任遺伝子やストレスなどの環境要因をin vivo機能解析で特定し、これが幹細胞の分化運命決定において果たす役割を明らかにする必要がある。そこで本研究では、精子幹細胞競合に関わる責任遺伝子・ストレスが精子幹細胞の運命決定に与える影響を解析する。具体的には、幹細胞系譜追跡・遺伝子発現操作・細胞分化度解析を可能にするモデルマウスを作出し、in vivo系譜追跡により精子幹細胞競合の責任遺伝子・ストレスを特定する。そして、申請者独自開発の器官培養デバイスで幹細胞競合をin vitro再構成し、特定した遺伝子・ストレスが精子幹細胞の細胞運命選択において果たす役割を明らかにする。この研究を元に、長期的な妊孕性の維持を担うべき精子幹細胞が敢えて『敗けて消え去る』プログラムを有する意義を知りたい。